Prácticamente todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las intensas fuerzas que mantienen unidos los átomos en las distintas sustancias se denominan enlaces químicos.
¿Por qué se unen los átomos?
Los átomos se unen porque, al estar unidos, adquieren una situación más estable que cuando estaban separados.
Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles.
Los gases nobles tienen muy poca tendencia a formar compuestos y suelen encontrarse en la naturaleza como átomos aislados. Sus átomos, a excepción del helio, tienen 8 electrones en su último nivel. Esta configuración electrónica es extremadamente estable y a ella deben su poca reactividad.
Distintos tipos de enlaces
Las propiedades de las sustancias dependen en gran medida de la naturaleza de los enlaces que unen sus átomos.
Existen tres tipos principales de enlaces químicos: enlace iónico, enlace covalente y enlace metálico
Enlace Iónico
Este enlace se produce cuando átomos de elementos metálicos (especialmente los situados más a la izquierda en la tabla periódica -períodos 1, 2 y 3) se encuentran con átomos no metálicos (los elementos situados a la derecha en la tabla periódica -especialmente los períodos 16 y 17).
En este caso los átomos del metal
ceden electrones a los átomos del no metal, transformándose en iones
positivos y negativos, respectivamente. Al formarse iones de carga opuesta
éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y
dando lugar a un compuesto iónico. Estas fuerzas eléctricas las llamamos
enlaces iónicos.
Une los átomos de la animación para simular el enlace:
Ejemplo: La sal común se forma cuando los átomos del gas cloro se ponen en contacto con los átomos del metal sodio. Imágenes de LiF (fluoruro de litio) y de NaCl (cloruro de sodio – sal común)
Une los átomos de la animación para simular el enlace:
Ejemplo: La sal común se forma cuando los átomos del gas cloro se ponen en contacto con los átomos del metal sodio. Imágenes de LiF (fluoruro de litio) y de NaCl (cloruro de sodio – sal común)
Debido a su estructura, los sólidos iónicos tienen las siguientes propiedades:
- No son volátiles y tienen un punto de fusión alto (normalmente entre 600 °C y 2.000 °C). Para fundir el sólido deben romperse los enlaces iónicos, separando unos de otros los iones con cargas opuestas. Los iones adquieren energía cinética suficiente para que esto ocurra solamente a temperaturas elevadas
- Los sólidos iónicos no conducen
la electricidad, puesto que los iones cargados tienen posiciones fijas. Sin
embargo, llegan a ser buenos conductores cuando están fundidos o disueltos
en agua. En ambos casos, fundidos o en disolución, los iones son libres
para moverse a través del líquido y así pueden conducir una corriente
eléctrica.
- La mayoría de los compuestos iónicos, pero no todos (p. ej., el NaCl si, pero no el CaCO3), son solubles en agua
- La mayoría de los compuestos iónicos, pero no todos (p. ej., el NaCl si, pero no el CaCO3), son solubles en agua
Enlace covalente
Los enlaces covalentes son las fuerzas que mantienen unidos entre sí los átomos no metálicos (los elementos situados a la derecha en la tabla periódica -C, O, F, Cl, ...).
Estos átomos tienen muchos electrones en su nivel más externo (electrones de
valencia) y tienen tendencia a ganar electrones más que a cederlos, para
adquirir la estabilidad de la estructura electrónica de gas noble. Por tanto, los átomos no metálicos no
pueden cederse electrones entre sí para formar iones de signo opuesto.
En este caso el enlace se forma al compartir un par de electrones entre los dos átomos, uno procedente de cada átomo. El par de electrones compartido es común a los dos átomos y los mantiene unidos, de manera que ambos adquieren la estructura electrónica de gas noble.
Se forman así habitualmente moléculas: pequeños grupos de átomos unidos entre sí por enlaces covalentes.
Une los átomos de la animación para simular el enlace:
Ejemplo: El gas cloro está formado por moléculas, Cl2, en las que dos átomos de cloro se hallan unidos por un enlace covalente. Imágenes de CO2 (dióxido de carbono) y de ClH (cloruro de hidrógeno)


En este caso el enlace se forma al compartir un par de electrones entre los dos átomos, uno procedente de cada átomo. El par de electrones compartido es común a los dos átomos y los mantiene unidos, de manera que ambos adquieren la estructura electrónica de gas noble.
Se forman así habitualmente moléculas: pequeños grupos de átomos unidos entre sí por enlaces covalentes.
Une los átomos de la animación para simular el enlace:
Ejemplo: El gas cloro está formado por moléculas, Cl2, en las que dos átomos de cloro se hallan unidos por un enlace covalente. Imágenes de CO2 (dióxido de carbono) y de ClH (cloruro de hidrógeno)


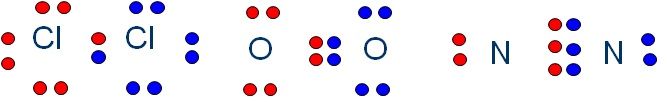
Los enlaces covalentes pueden compartir 1, 2 o 3 electrones de valencia. Se llaman enlaces simples, dobles o triples. Aquí tienes un ejemplo de cada uno de ellos: Cl2, O2 y N2
Sustancias gaseosas o líquidas:
Sustancias gaseosas o líquidas:
Prácticamente
todas las sustancias que son gases o líquidos a 25 ºC y a la presión normal son
moleculares. Estas sustancias están constituidas por partículas discretas
llamadas moléculas, que a su vez están formadas por dos o más átomos
unidos por unas fuerzas muy intensas llamadas enlaces covalentes. En
cambio las fuerzas entre las moléculas próximas son bastante débiles. Para
fundir o hacer hervir una sustancia molecular, las moléculas deben liberarse
unas de otras. La debilidad de las fuerzas de atracción entre las moléculas que
componen estas sustancias hace que se necesite poca energía para separarlas por
lo que presentan bajos puntos de fusión y de ebullición. En cambio, en estas
transformaciones los enlaces covalentes dentro de las moléculas permanecen
intactos.
Ejemplos: el
agua (H2O) o el alcohol (C2H6O2), y
gases el nitrógeno del aire (N2) o el dióxido de carbono (CO2
Los átomos que forman estas
sustancias están unidos por una red continua de enlaces covalentes,
formando lo que se denomina una red cristalina.
Sustancias sílodas:
Entre las sustancias que forman sólidos de red covalente se encuentran tanto elementos, por ejemplo el diamante (C), como compuestos, por ejemplo el cuarzo (SiO2).
En el diamante los enlaces covalentes C -C se extienden a través del cristal formando una estructura tridimensional tetraédrica.
En el cuarzo, cada átomo de silicio se une tetraédricamente a cuatro átomos de oxígeno. Cada átomo de oxígeno se une a dos silicios y así une tetraedros contiguos entre sí. Esta red de enlaces covalentes se extiende a través de todo el cristal.
Los sólidos de red covalente presentan propiedades características:
- Son muy duros.
- Tienen elevado punto de fusión, con
frecuencia alrededor de 1.000 °C o mayores. Esto es debido a que para fundir el
sólido, deben romperse los fuertes enlaces covalentes entre sus átomos. Los
sólidos de este tipo son notablemente diferentes de los sólidos moleculares,
que tienen puntos de fusión mucho más bajos.
- Son insolubles en todos los disolventes
comunes. Para que se disuelvan, tienen que romperse los enlaces covalentes
de todo el sólido.
- Son malos conductores de la electricidad.
En la mayoría de las sustancias de red covalente no hay electrones móviles que
puedan transportar una corriente.
Enlace metálico
Para explicar las propiedades características de los metales se ha elaborado un modelo de enlace metálico conocido como modelo de la nube o del mar de electrones:
Los átomos de los metales tienen pocos electrones en su última capa, por lo general 1, 2 ó 3. Éstos átomos pierden fácilmente esos electrones (electrones de valencia) y se convierten en iones positivos, por ejemplo Na+, Cu2+, Mg2+. Los iones positivos resultantes se ordenan en el espacio formando la red metálica. Los electrones de valencia desprendidos de los átomos forman una nube de electrones que puede desplazarse a través de toda la red. De este modo todo el conjunto de los iones positivos del metal queda unido mediante la nube de electrones con carga negativa que los envuelve.
características de los metales:
- Conductividad eléctrica elevada. La presencia de un gran número de electrones móviles explica por qué los metales tienen conductividades eléctricas varios cientos de veces mayores que los no metales. La plata es el mejor conductor eléctrico pero es demasiado caro para uso normal. El cobre, con una conductividad cercana a la de la plata, es el metal utilizado habitualmente para cables eléctricos.
- Buenos conductores del calor. El calor se transporta a través de los metales por las colisiones entre electrones, que se producen con mucha frecuencia.
- Estado sólido. Todos los metales están en estado sólido a temperatura ambiente, salvo el mercurio.
- Ductilidad y maleabilidad. La mayoría de los metales son dúctiles (capaces de ser estirados para obtener cables) y maleables (capaces de ser trabajados con martillos en láminas delgadas). En un metal, los electrones actúan como un pegamento flexible que mantiene los núcleos atómicos juntos, los cuales pueden desplazarse unos sobre otros. Como consecuencia de ello, los cristales metálicos se pueden deformar sin romperse.
- Insolubilidad en agua y en otros
disolventes comunes.
Ningún metal se disuelve en agua; los electrones no pueden pasar a la
disolución y los cationes no pueden disolverse por ellos mismos.
- Brillo metálico. Los
metales presentan un brillo metálico característico. Imagen del aluminio.